بقلم : الدكتور / إيهاب شكرى محمد باحث البكتريولوجيا
معهد بحوث الصحه الحيوانيه – فرع دمنهور
يعد التهاب الضرع في الأبقاروالجاموس الحلابة من أهم الأمراض وأكثرها تأثيرا نظرا لما يسببه من خسائر اقتصادية ناجمة عن تكلفة برامج التحصين أو العلاج المرتفعين، استبعاد الإنتاج من الألبان نتيجة تغير صفاته على المستويين الظاهري و الحسي بالإضافة لاحتوائه على كميات عالية من المضادات الحيوية مما يعوق عمليات تصنيعه المختلفة، بالإضافة إلى احتمالية استبعاد البقر الحلاب بشكل كامل من القطيع كما في بعض حالات التهابات الضرع المزمنة ، أو في بعض الحالات نفوق الأبقار المفاجيء المترتب على بعض الإصابات شديدة الضراوة.
التهاب الضرع تحت السريري هو أكثر الأنواع شيوعا ومن أكثرها ضررا على القطيع الحلاب نتيجة انخفاض الإنتاج المستمرالخفي مع ارتفاع عدد الخلايا الجسدية في اللبن بالإضافة لسهولة انتقال العدوى بشكل خفي ما بين أفراد القطيع وربما إلى العجول الرضيعة.
لطالما اعتبرت المكورات العنقودية من أهم البكتريا المسببة لالتهاب الضرع بأنواعه المختلفة وعلى رأسها المكورات العنقودية الذهبية سيئة السمعة وشديدة الخطورة، لكن لفترة طويلة أغفل دور المكورات العنقودية سالبة التجلط على الرغم من كونها أصبحت أكثر الأسباب البكتيرية المعزولة من حالات التهاب الضرع طبقا لتقارير عديدة على مستوى العالم.
المكورات العنقودية الذهبية Staphylococcus Aureus
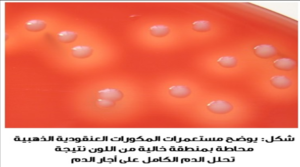
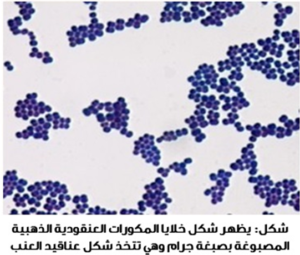
بكتيريا موجبة غرام، غير متحركة. سميت بهذا الاسم (مكورات عنقودية) لأنها تترتب بشكل كرات غير منتظمة تشبه عنقود العنب عند رؤيتها تحت المجهر، اما تسمية (ذهبية) وذلك لأنها تظهر على شكل مستعمرات صفراء اللون عند زراعتها على وسط آجار الدم Blood Agar وتستطيع تحليل خلايا الدم الحمراء بشكل تام وهي لاهوائية اختيارية (تستطيع المعيشة في وجود وفي غياب الاكسجين).
تنتج بكتيريا المكورات العنقودية الذهبية عدداً من السموم التي تميزها في الأوساط الغذائية تحت ظروف معينه ومنها سموم الفا Hemolysin Alpha وهي التي تحلل خلايا الدم الحمراء في الارانب. وسموم بيتا Hemolysin Beta التي تؤدي الي تحلل خلايا الدم الحمراء للأغنام وكذلك السموم التي تؤدي الى تحلل خلايا الدم البيضاء Leukocidins. وكذلك تنتج بكتيريا المكورات العنقودية الذهبية السموم المعوية Enterotoxins المسؤولة عن عدد كبير من حالات التسمم الغذائي. ومن عوامل الشراسة Virulence factors وجود عوامل الالتصاق وقدرتها على تكوين الأغشية الحيوية Biofilms التي تساعد البكتيريا على البقاء على قيد الحياة داخل في بيئة العائل المضيف، وتعتبر مسؤولة عن الالتهابات المزمنة أو المستمرة. حيث يعتبر عامل مقاومة عالية للعلاج بالمضادات الحيوية. لطبيعتها كونها تعمل كحاجز لمنع تغلغل المضادات الحيوية، وربما لاحتوائها على إنزيمات مضادة للمضادات الحيوية مثل البيتا لاكتمازيزات.
أظهر البنسلين عند اكتشافه فعالية عالية مضادة للمكورات العنقودية الذهبية، حيث يعمل البنسلين على تثبيط تكوين الروابط الببتيدوجليكانية “التي توفر الصلابة والقوة لجدار الخلية البكتيرية” فتؤثر على تكون جدار الخلية، مما يؤدي إلى موتها. على الرغم من ذلك، فإن مشكلة مقاومة البنسلين أصبحت شائعة وازدادت في الآونة الأخيرة لتصبح نسبة المقاومة قريبة من 100% في معظم دول العالم. هناك مجموعة كبيرة من المضادات الحيوية التي استخدمت لعلاج الالتهابات الناتجة عن المكورات العنقودية الذهبية مثل الاريثروميسين، سيفالوسبورين، كلينادميسين، لينوميسين، اريثروميسين، ميثيسيلين، نافيسيلين والفانكوميسين. أظهرت المكورات العنقودية الذهبية مقاومة للميثيسيلين وأصبحت تعرف باسم Methicillin-Resistant Staphylococcus Aureus واختصاراً MRSA، هي نوع من المكورات العنقودية الذهبية المقاومة للمضاد الحيوي الميثيسيلين ومضادات حيوية من نفس الفئة، بما في ذلك البنسلين، أموكسيسيلين، وأوكساسيلين.. هذه المقاومة للميثيسيلين نشأت عن التعبير الجيني لمركب methicillin-hydrolysing β-lactamase5، ومن خلال التعبير الجيني للبروتين المرتبط بالبروتين PBP2.
يتم التعرف على سلالات المكور العنقودى الذهبى المقاوم للفانكوميسين المضاد الذي كان بإمكانه معالجة العدوى الناشئة عن MRSA. ويشار إلى هذه البكتيريا باسم البكتيريا العنقودية الذهبية ذات المقاومة المتوسطة للفانكومايسين (VISA).
ويرجع ذلك لعدة تغيرات في الجينات وعدة طفرات لجينات المسؤولة عن تصنيع الغلاف الحيوي للخلية. وفي العام 2002 تم تسجيل مقاومة بشكل كامل للفانكوميسين (VRSA) ويتم اكتسابه أو نقله من خلال جينات تسمى Van-A الموجودة على البلازميدات.